
疟疾是由恶性疟原虫红细胞膜蛋白1(PfEMP1)介导的被感染红细胞在微血管中的积聚所驱动。PfEMP1通过其富含半胱氨酸的结构域间α1区(CIDRα1)与人内皮蛋白C受体(EPCR)结合,进而导致恶性疟疾发病。然而,该结构域存在非常多的变体,给相关抗疟疗法的开发带来挑战。因此,长期以来有一个悬而未解的问题,即由个体产生的抗体能否识别大量带有不同CIDRα1结构域的PfEMP1变体。
在本文中,研究团队从疟疾高发地区人血中分离并表征了两种针对CIDRα1的广谱作用单抗,它们可以识别六个CIDRα1亚类中的五个,并能抑制CIDRα1与EPCR的结合。在模拟生理血流状态的三维人脑微血管模型中,两种抗体均能抑制受感染红细胞在人内皮细胞表面粘附。结构研究显示,这两种抗体有着相似的作用机制,它们通过与CIDRα1中与EPCR结合的三个高度保守氨基酸残基的相互作用,从而抑制CIDRα1与EPCR的结合。这些广谱作用的抗体可能代表了针对严重疟疾的获得性免疫的一种通用机制,同时也为相关疫苗或治疗方案设计提供了新的思路。
从人血中发现并表征CIDRα1广谱型抗体
乌干达的托罗罗镇是疟疾传播强度极高的地区,据估算,该地区每人每年会遭受125次感染性叮咬。因此,本研究采集了该地区3名成人的血样,以两个差异巨大的CIDRα1变体作为抗原进行单B细胞筛选和测序,同时对抗体与34种CIDRα1变体的结合活性进行评估(图1 a b)。其中C7、C62、C74抗体对大部分CIDRα1亚类(5/6)具有广谱的结合能力和EPCR结合抑制作用(图1 c)。通过对序列的分析发现,C7和C62属于同一克隆谱系,且几乎完全相同,故而对C7和C74进行后续研究。以IgG1形式重组表达的C7和C74保留了对不同CIDRα1的结合能力,和EPCR的结合抑制作用(图1 d)。生物膜干涉结果表明,C7和C74以高亲和力与多种CIDRα1变体结合(图1 f)。研究团队使用了于2007年采集的中低疟疾传播水平地区的93名个体的血样,发现C7 Fab可以通过竞争结合来抑制这些血样中IgG对不同CIDRα1的结合作用(图1 e)。这些结果表明,大部分能够识别CIDRα1的IgG表位与C7重叠。
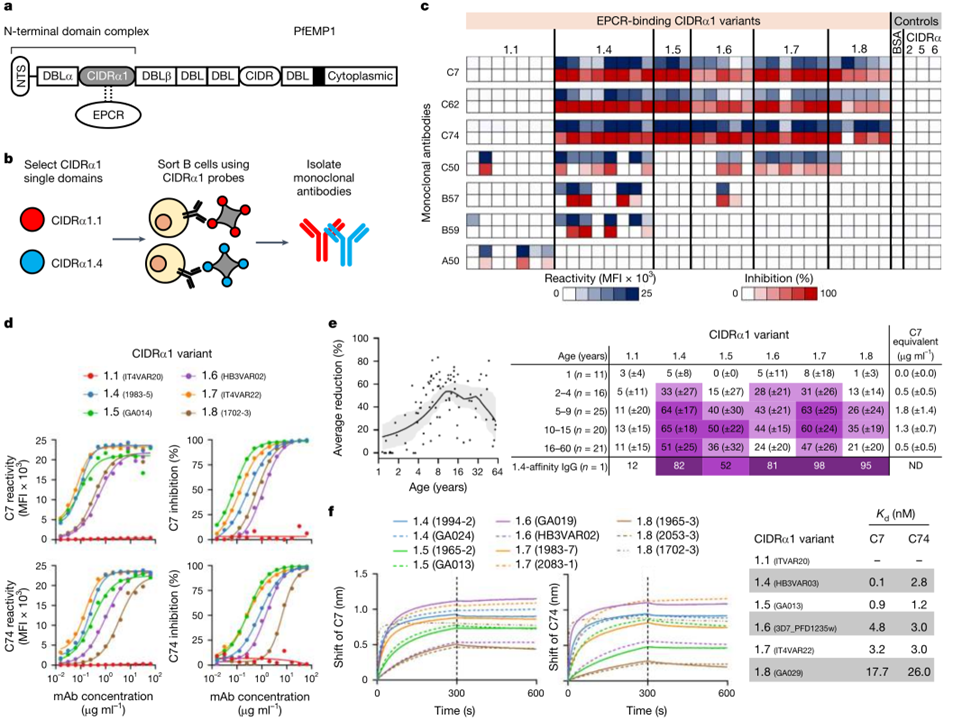
图1 发现靶向PfEMP1 CIDRα1结构域的单克隆抗体
C7和C74抑制受疟原虫感染的红细胞在人内皮细胞表面粘附
接下来研究团队对C7和C74能否与受疟原虫感染红细胞表面的PfEMP1结合进行了评估。流式细胞术结果显示,C7和C74可以结合表达PfEMP1 CIDRα1.4、CIDRα1.6,而非CIDRα1.1的受感染红细胞,这与上述抗体亲和力评估的结果相吻合(图2 a)。进一步,研究团队采用体外三维人脑微血管模型,模拟在脑动静血管中的流速和应力,发现这两种抗体可以抑制受感染红细胞在人内皮细胞表面的粘附(图2 b)。
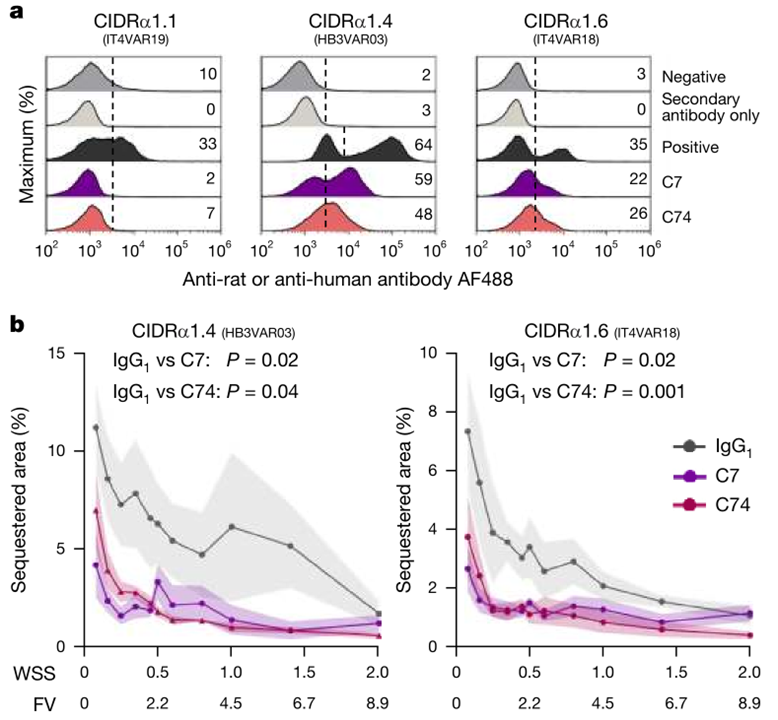
图 2 C7和C74对受恶性疟原虫感染的红细胞的结合及细胞粘附抑制作用
C7靶向CIDRα1与EPCR的结合位点
首先,研究团队解析了C7 Fab与CIDRα1.4的结构,发现C7 Fab能够直接结合到CIDRα1.4的EPCR结合(EB)螺旋以及EPCR结合辅助(EBS)螺旋这两个EPCR结合的关键区域上,直接阻断CIDRα1.4与EPCR的结合(图3 a-c)。
进一步,为了探究C7广谱作用的分子机制,研究团队解析了C7与PfEMP1蛋白N末端结构域(NTS–DBLα–CIDRα1.7–DBLβ)的结合机制(图3 d)。虽然DBLα和DBLβ由于高度灵活无法解析,但解析了C7与CIDRα1.7的结合界面(图3 e)。将C7 Fab-CIDRα1.4和C7 Fab-CIDRα1.7的结构叠加发现,C7的表位几乎一致(图3 f)。
具体而言,C7的主要结合作用机制如下:1.CIDRα1与EPCR的结合中心有一个保守的双苯丙氨酸基序(FF),能够形成一个疏水区域,使第二个F能够伸入EPCR的疏水口袋,进而形成稳定的复合物。C7 H-CDR3形成了一个疏水凹槽,含有三个芳香族氨基酸,使得FF可以伸入并形成π 堆积相互作用,从而模拟EPCR与CIDRα1的结合。2.除了FF基序外,C7的结合还依赖于CIDRα1 EBS N末端保守的谷氨酸位点与H-CDR3的酪氨酸和丝氨酸的相互作用(图3 g)。类似地,研究团队对C74的结合机制进行了解析,发现C7与C74具有相似的作用模式。
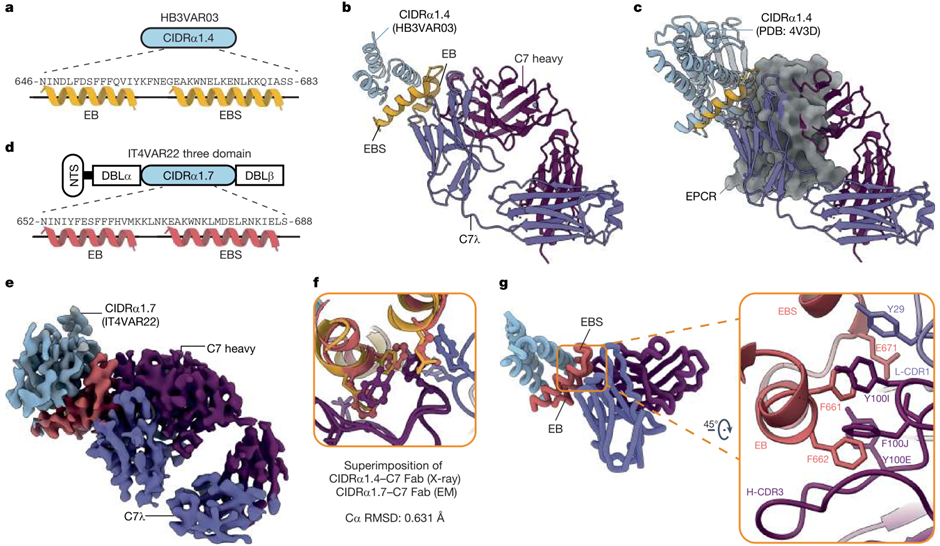
图 3 C7 Fab与PfEMP1 N末端结构域的结合机制
CIDRα1被C7和C4识别的关键表位是保守的
CIDRα1中C7和C74的结合位点在很大程度上重叠,在EB和EBS上共有十个公共位点,它们大多暴露在未结合的PfEMP1复合物表面,其中4个是保守的,包括前面提到的FF和E。当把CIDRα1.4、CIDRα1.5或CIDRα1.8中的FFE任一位点替换为丙氨酸时,会导致C7和C74的亲合力下降。CIDRα1.1在EB上有一个LF/Y基序,且在EBS N末端的赖氨酸与CIDRα1.4–1.8相比发生了1个氨基酸的位移。将这些位点突变,形成FF基序和处于正确位置的赖氨酸,使得C7和C74获得了对CIDRα1.1的结合能力。这些结果表明这三个关键氨基酸位点对CIDRα1的广谱识别能力的重要性(图4 a-c)。
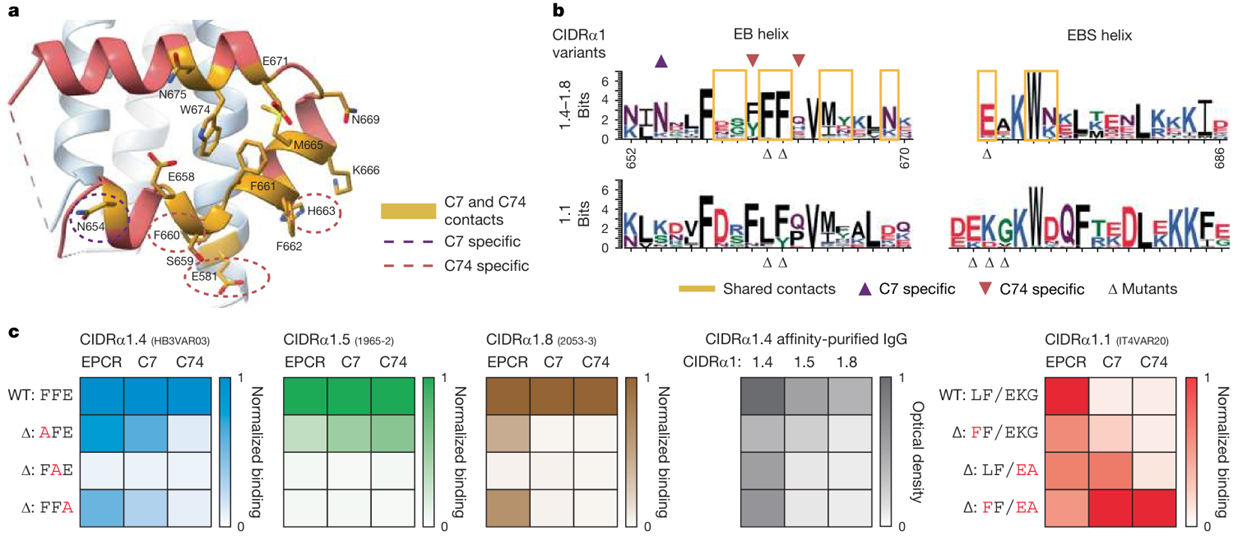
图 4 C7和C74识别CIDRα1表位的保守性和表面暴露情况
C7对CIDRα1的广谱性依赖于体细胞超突变(SHM)
C7和C74在H-CDR3长度、SHM、轻链配对方面存在差异,但均使用重链V基因VH3–48,因此研究人员推测,这个V基因是否足以支撑抗体对不同CIDRα1的广谱作用。通过分别将C7重链、轻重链除CDR3以外部分的突变回复成胚系,发现两种抗体对CIDRα1的广谱作用消失了(图5 a-b)。分子动力学模拟研究表明,C7的H-CDR3呈现单一主要构象,而将突变回复成胚系后,H-CDR3表现出高构象多样性,结构不稳定(图5 c)。并且,将H–CDR1回复为胚系后,C7的广谱作用消失,而回复H–CDR2无此影响(图5 d)。这表明成熟的H–CDR1在C7广谱作用方面的重要性,同时也说明SHM对获得针对CIDRα1的广谱型抗体至关重要。
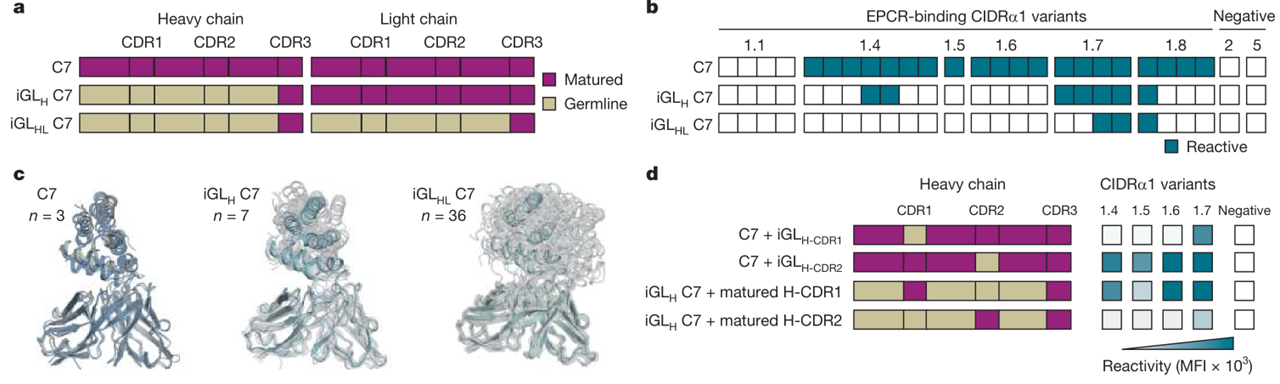
图 5 C7单克隆抗体的胚系基因分析
关注点
1. 本研究从疟疾高度传播地区人群的血液中发现了对不同CIDRα1变体具有广谱结合作用的抗体C7和C74,并解析了它们相似的作用机制。这一发现极大地推进了疟疾的发病机制研究,同时也为抗疟疾疫苗和药物的研发带来了新的契机。
2. 本文中使用的抗体筛选和表征策略,也可应用于其他靶蛋白高度多变的疾病研究,通过筛选广谱性抗体并解析其作用机制,可能找到高变靶蛋白的关键保守表位,用于相关疗法和药物的研发。
3. Rapid Novor(快序生物)是全球唯一能实现血清多抗直接测序的公司。利用该技术,可以快速从人血清多抗中获得优质抗体,助力抗体药物研发。例如对于本研究,可以通过抗原富集对CIDRα1具有广谱结合能力的抗体,直接测序获得单抗序列。
4. 文中使用了2007年采集的血样,从中富集到了能结合CIDRα1的IgG。这一结果表明即使长期保存,血样中的多抗依然可以保持生物学功能,可用于抗体测序。因此血清多抗测序技术也非常适合用于这类珍贵样本的分析。
参考文献
[1] Reyes RA, Raghavan SSR, Hurlburt NK, Introini V, Bol S, Kana IH, Jensen RW, Martinez-Scholze E, Gestal-Mato M, López-Gutiérrez B, Sanz S, Bancells C, Fernández-Quintero ML, Loeffler JR, Ferguson JA, Lee WH, Martin GM, Theander TG, Lusingu JPA, Minja DTR, Ssewanyana I, Feeney ME, Greenhouse B, Ward AB, Bernabeu M, Pancera M, Turner L, Bunnik EM, Lavstsen T. Broadly inhibitory antibodies to severe malaria virulence proteins. Nature. 2024 Dec;636(8041):182-189. doi: 10.1038/s41586-024-08220-3.