 基于抗体的免疫疗法已经成为了癌症治疗的重要手段,例如单抗、抗体偶联药物(ADC)、双抗、T细胞衔接器(TCE)(图1)。虽然这些方法有效性高,但癌细胞上的大多数靶点也存在于健康细胞上,这些高毒性的分子即使仅有少量在肿瘤组织外结合也能导致严重的副作用。本文探讨了将抗体药物选择性导向肿瘤的策略。借助于分子设计、抗体工程改造等领域的技术突破,可以制造出利用肿瘤和人体差异的药物,使其不但区分自身与非自身,还有效区分肿瘤和健康组织。
基于抗体的免疫疗法已经成为了癌症治疗的重要手段,例如单抗、抗体偶联药物(ADC)、双抗、T细胞衔接器(TCE)(图1)。虽然这些方法有效性高,但癌细胞上的大多数靶点也存在于健康细胞上,这些高毒性的分子即使仅有少量在肿瘤组织外结合也能导致严重的副作用。本文探讨了将抗体药物选择性导向肿瘤的策略。借助于分子设计、抗体工程改造等领域的技术突破,可以制造出利用肿瘤和人体差异的药物,使其不但区分自身与非自身,还有效区分肿瘤和健康组织。
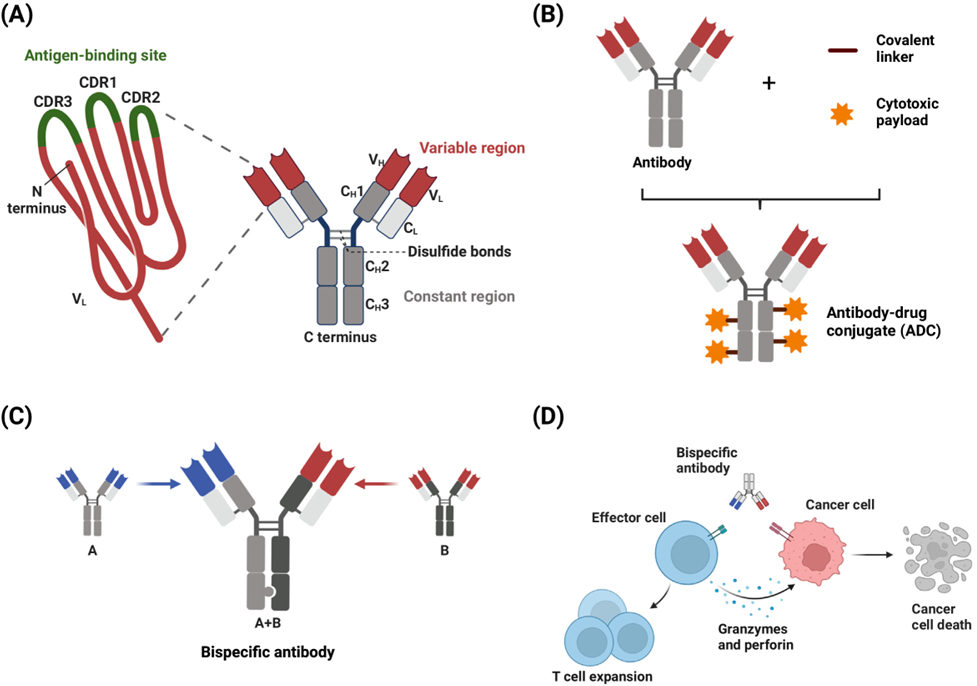
图1常见基于抗体的疗法的结构
利用癌细胞特征的策略
抗体药物常使用的靶点大多在正常的细胞中也有分布,可能导致非肿瘤靶向毒性。因此开发ADC和TCE疗法,更好的选择是靶向癌细胞特有的肿瘤特异性抗原(TSA),或者在癌细胞中高表达的肿瘤相关抗原(TAA)。
靶向TSA的策略
癌细胞具有一些独特的分子特征,例如它可能会表达在正常细胞中处于沉默状态的基因,或者突变基因而产生的蛋白质变体,它们被降解后产生的肽段被主要组织相容性复合体(MHC)呈递到细胞表面从而构成TSA。具有高突变负荷的肿瘤,如黑色素瘤和肺癌往往含有更多TSA,但可惜的是,很难找到在患者中共有的“公共新抗原”。靶向TSA的一种策略,是通过例如T细胞受体(TCR)或TCR模拟抗体识别癌细胞表面MHC递呈的TSA(图2 A),另一种策略是通过不同手段将抗体输送入肿瘤细胞。例如将表达靶向TSA的单链抗体(scFv)的基因转入癌细胞,从而在胞内表达抗体与TSA结合(图2 B)。还有策略通过不同方法透膜,例如将抗体与细胞穿透肽等偶联(图2 C)。也有研究利用IgA二聚体的穿胞作用,使其进入癌细胞与TSA结合(图2 D)。
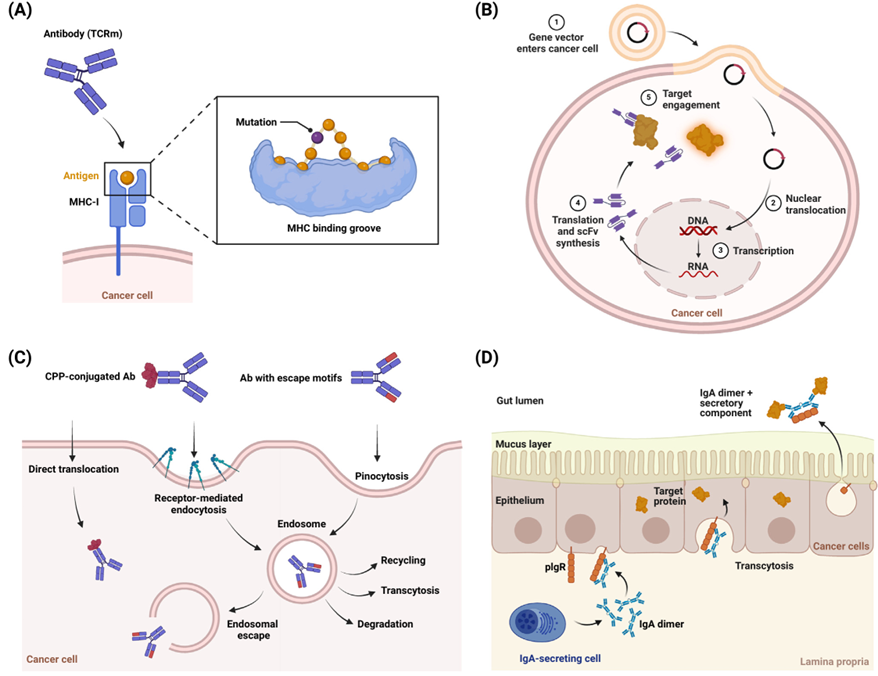
图2.利用肿瘤微环境特征的策略
靶向TAA的策略
TAA是指在肿瘤和正常细胞均表达,但是在肿瘤中表达较高的一类抗原。因此要提高对肿瘤细胞的选择性就需要利用其他特性,比如靶点密度的差异或多个靶点的共表达情况。例如,使用多价抗体,其更易结合在高抗原密度的癌细胞上,这一现象被称为“超选择性”(图3)。可行的方式包括使用IgM,IgG六聚化等。通过在抗体恒定区引入非共价互作的方法也可增加抗体在肿瘤细胞表面的留存。除此外,还可以通过靶向同一肿瘤细胞上多个抗原,提升多抗的肿瘤细胞选择性。
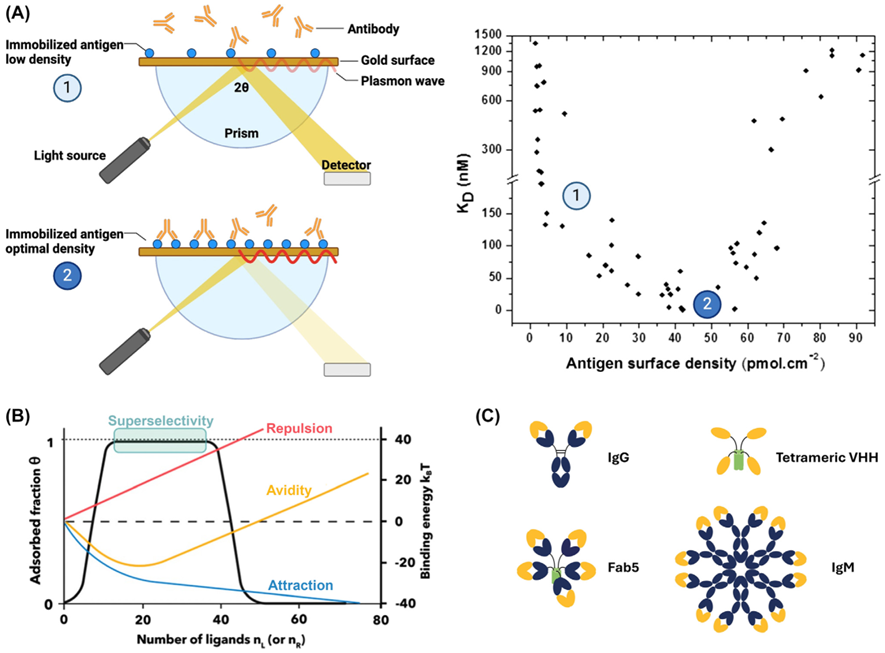
图3.改造提高抗体对特定抗原的密度选择性
然而,最大化药物的靶点亲和力常常不是最佳策略。高亲和力可能导致药物识别正常细胞上的抗原,从而产生毒性。并且过高的抗原亲和力可能导致抗体的细胞内化速率增加,减慢其与抗原解离和从晚期内体再循环,导致被溶酶体降解,从而限制其半衰期和肿瘤穿透能力。紧密的结合作用可能减少受体聚集和信号传导,例如对TCE的研究表明,中等亲和力时可以达到最好效果。
利用肿瘤微环境的策略
肿瘤微环境(TME)的一些特征,例如持续性炎症、细胞外基质(ECM)重塑、异常血管生成、坏死等等可能为抗体药物的设计提供依据。
TME特征可成为选择性抗体的合适靶点
TME的一个特征是存在免疫细胞,抗体如免疫检查点抑制剂可减轻TME中的免疫抑制,或增强免疫激活。多特异性抗体非常适合靶向免疫突触相关分子,从而将免疫细胞与癌细胞结合。TME的另一个特征是存在癌相关成纤维细胞(CAFs),它们可影响肿瘤的免疫调节和侵袭性,因此靶向它们的抗体可发挥抗癌作用。实体瘤的高代谢需求会引起异常的血管生成,因此干扰血管生成的药物也被应用。晚期实体瘤的另一典型特征是坏死微环境,可以针对暴露出来的分子设计抗体,称为肿瘤坏死疗法(TNT)。而由于TNT不与活细胞结合,所以需要结合能扩散或发挥远距离杀伤作用的药物,例如放射性核素、免疫调节剂以及释放型化疗药物。
改造抗体药物使其在TME中选择性激活
可以根据TME中大量存在的分子,例如蛋白酶设计抗体前药分子。在肿瘤外,抗体上带有的遮蔽肽阻碍其与抗原结合,而在肿瘤内,遮蔽肽被蛋白酶切掉,从而发挥作用(图4 A)。通过肿瘤组织内的酶切作用,还可以裂解ADC的连接子,从而选择性释放毒素分子。TME中的其他分子,例如高浓度的三磷酸腺苷(ATP)可以作为分子胶,补充抗体互补决定区(CDR)与抗原的结合界面,从而介导抗体发挥作用(图4 B)。此外,TME通常呈酸性,因此可以对抗体进行优化,使其在低pH下发挥作用。例如可以通过对pH敏感的CDR区设计出酸性条件下优先结合的抗体(图4 C)。另外使抗体可结晶片段(Fc)对pH敏感,可以有利于将效应细胞募集到TME(图4 D)。
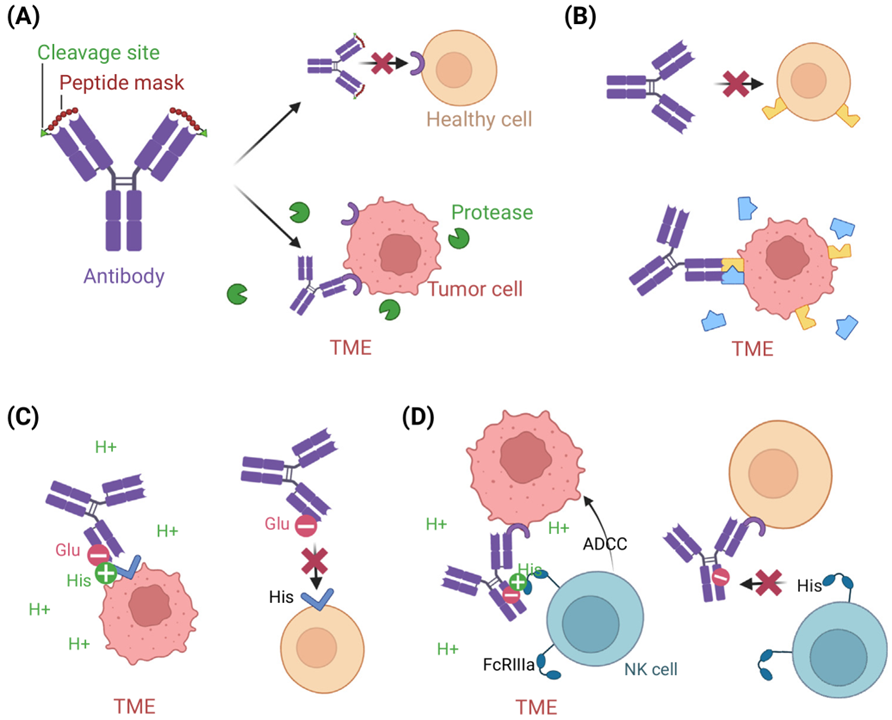
图4.通过工程改造使抗体在TME中选择性激活
利用外部干预的策略
除了利用肿瘤和TME特征外,可以用外部手段提高肿瘤内药物浓度,或降低肿瘤外的药物浓度。
提高肿瘤内活性药物的浓度
给药策略会影响药物的运输和积聚情况。例如一项研究中,通过腹腔注射抗体药物在瘤内的聚集比静脉注射高出8倍。外部刺激手段,例如辐照、光热可以在时间和空间上控制药物的浓度。此外额外注射一些分子,例如具有催化活性的分子可用于肿瘤部位选择性激活抗体前药。还可以设计具有相互关联活性的抗体对,使其仅在同时结合两种抗体或仅结合其中一种抗体的细胞上发挥功能(类似电路中的“与”门和“非”门)。通过放疗等方法处理,可使抗原暴露增加,从而改善后续免疫疗法的效果。药物诱导新抗原,结合新抗原靶向治疗也是正在探索的方向。
降低肿瘤外活性药物的浓度
降低肿瘤外活性药物浓度的一种策略是使用该治疗药物的无毒类似物来阻断在肿瘤外的结合。例如先注射不带载荷的裸抗,再注射ADC,可以使ADC分子更好定位到肿瘤部位。另一种策略是,利用肿瘤外靶点密度较低的现象构建的间接主动靶向(INTACT)策略。首先将抗体结合在表达一定量靶点的囊泡上,抗体会倾向在靶点浓度更高的肿瘤组织,而非靶点浓度更低的正常组织中释放。第三种策略是,利用抗体药物在肿瘤外更容易清除这一特点,例如OncoOne公司基于双特异性抗体的PreTarg-it平台。双抗其中一端识别肿瘤细胞表面抗原,当在抗体已聚集在肿瘤上,且在血液中清除后,注射带有放射性载荷的抗体结合区域,与双抗的另一端结合。另一种方法是逆向靶向,通过注射抗体或小分子,加速肿瘤外ADC或TCE的清除或脱离。
改造选择性抗体的新策略
蛋白质科学、结构生物学以及人工智能方面的进展使得研究人员可以同时优化抗体的多个特性,并更好地区分肿瘤靶点与健康细胞上的靶点。例如可以通过二硫键改造、非共价相互作用改变IgG的形状;对抗体的非CDR区改造以改善其结合能力、稳定性、结构刚性;通过CDR之间,以及恒定区之间的同型相互作用,大幅提高抗体的结合力。优化的多特异性抗体,例如zanidatamab可以靶向同一抗原上的多个表位。这些策略可以对靶点识别进行精细调节,从而提高选择性和安全性。
使用IgG外的抗体,将有助于解决穿透实体瘤的难题。例如纳米抗体(VHH);将不同免疫调节分子的结构域组合,生成例如含Fc段的抗体、抗体片段或Fc融合蛋白。目前,研究者已提出使用非抗体来源的支架用于抗体药物的设计,随着对分子设计原理的理解不断加深,可以通过从头蛋白质设计获得更多样化的分子。
关注点
1. 抗体药物的结构和设计日益精密,获得优质的抗体序列将助力抗体药物研究。
2. Rapid Novor(快序生物)全球领跑的蛋白从头测序技术可以获得任何抗体、蛋白的全长100%准确氨基酸序列。
3. Rapid Novor(快序生物)全球唯一的血清多抗测序技术可以获得经血液、免疫系统筛选的优质抗体,可开发性更高。
4. Rapid Novor(快序生物)基于质谱从头测序技术的肿瘤新抗原鉴定服务,可以一网打尽不同来源的新抗原肽段,用于抗肿瘤疗法的开发。
参考文献
[1] Blay V, Pandiella A. Strategies to boost antibody selectivity in oncology. Trends Pharmacol Sci. 2024 Nov 27:S0165-6147(24)00217-7. doi: 10.1016/j.tips.2024.10.005. Epub ahead of print. PMID: 39609227.