
肿瘤新抗原作为肿瘤免疫治疗的靶点极具研究价值,然而它们在肿瘤细胞表面的表达量可能极低,使得靶向新抗原的T细胞疗法开发面临挑战。在本文中研究团队发现,当靶向由人类白细胞抗原(HLA)I类分子呈递的p53R175H新抗原时,嵌合抗原受体(CAR)的敏感性比T细胞受体(TCR)低10-100倍。因此,研究团队通过“合成TCR和抗原受体(STAR)”来增强CAR的功能,开发了靶向常见p53R175H肿瘤新抗原的T细胞疗法。STAR表现出了与TCR相当的新抗原敏感性,且在体内外实验中,均可以识别肿瘤细胞表面低密度的p53R175H发挥抗肿瘤活性[1]。
结果
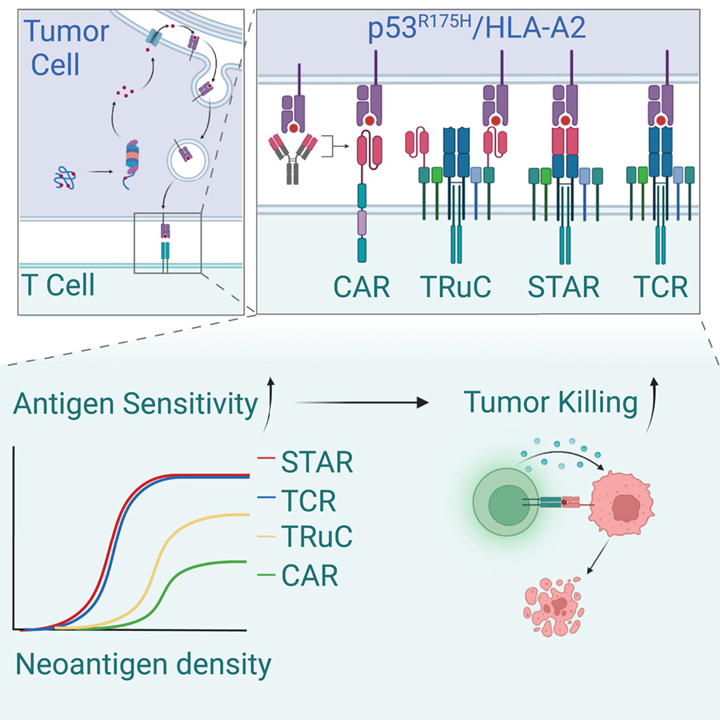
CAR对HLA I呈递p53R175H新抗原的敏感性远低于TCR
首先,研究团队基于靶向p53R175H的类TCR抗体(TCRm)和已报道的典型TCR构建了CAR-T和TCR-T,比较了它们对于HLA-A*02:01 (HLA-A2)呈递的p53R175H的敏感性(图1 A)。结果表明,除CD4⁺ TCR-1 T细胞外,其他构建的T细胞都表现出了较强的目的抗原结合能力(图1 B)。进一步的功能研究中发现,CAR-T在细胞毒性、激活T细胞、促干扰素- γ(IFN-γ)释放方面的抗原敏感性弱于TCR-T 10-100倍,TCR-T在低密度新抗原条件下仍能发挥抗肿瘤作用(图1 C-H)。
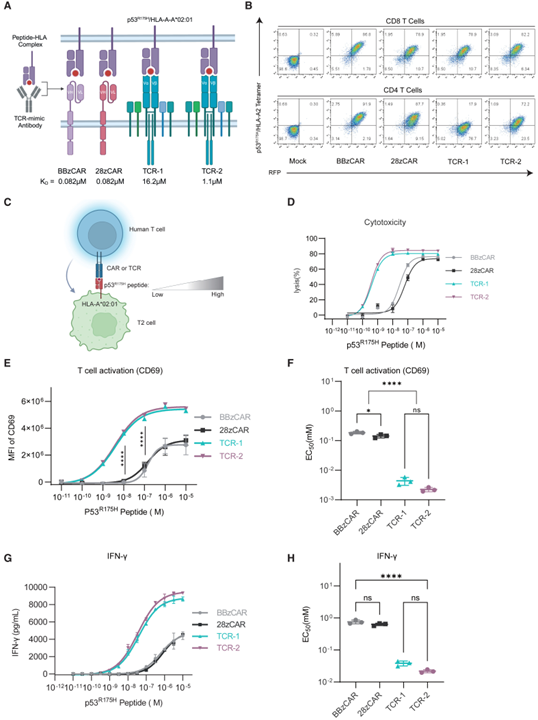
图1 CAR和TCR针对相同p53R175H/HLA-A2敏感性的对比分析
STAR-T复现TCR-T的高抗原敏感性
基于TCR和抗体的合成类受体主要分为三类:嵌合抗原受体(CAR)、T细胞受体融合构建体(TRuC)、合成T细胞受体和抗原受体(STAR)/HLA非依赖的T细胞受体(HIT)(图2 A)。它们都是将抗体对抗原的高亲和力特性与TCR的信号传导能力相结合。接下来研究团队便比较了不同合成类受体对新抗原的敏感性差异。
在CD8⁺ T细胞中,各受体均表现出了较好的结合抗原的能力(图 2B)。当改造的CD8⁺ T细胞受到搭载不同剂量新抗原肽段的T2细胞系刺激时,只有STAR-T细胞对低密度新抗原刺激保持了与TCR-1类似的高细胞毒性(图2 C)和促IFN-γ与肿瘤坏死因子α(TNF-α)释放能力(图2 D E)。STAR的抗原敏感性与TCR相似,比BBzCAR和28zCAR高出近100倍(图2 F-H)。
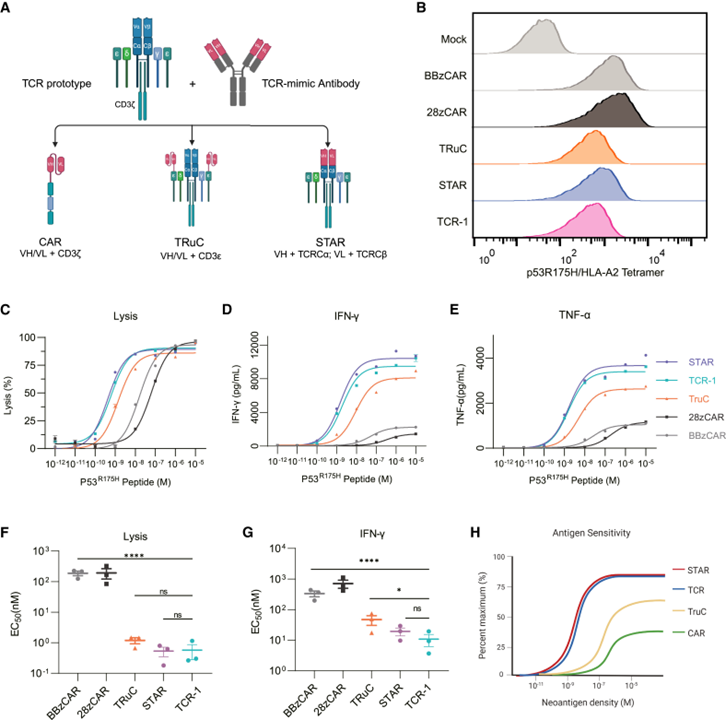
图 2. STAR 能重现 TCR 的抗原敏感性
CD4⁺ STAR-T可识别HLA I呈递的p53R175H新抗原,且不依赖CD8
除CD8+外,CD4⁺ T细胞在抗肿瘤免疫中也发挥着重要作用。CD4⁺ STAR-T细胞表现出了对T2细胞最优的细胞毒性、激活IFN-γ、TNF-α释放(图3 A-C)能力。综上所述,STAR在CD4⁺和CD8+T细胞中均表现出了最强的新抗原敏感性。
CD8可以辅助TCR与抗原肽-MHC I复合物的结合,因此研究团队分别采用了两种方法,探究CD8是否参与这些受体的作用:1.通过特异性抗体阻断CD8(图3 D E);2. 敲除T2细胞的内源性HLA-A2,并表达一种不与CD8结合,但保留与肽段和TCR相互作用的突变体HLA-A2(图3 F G)。结果表明CD4+ STAR-T和CAR-T的作用不需要CD8的参与。
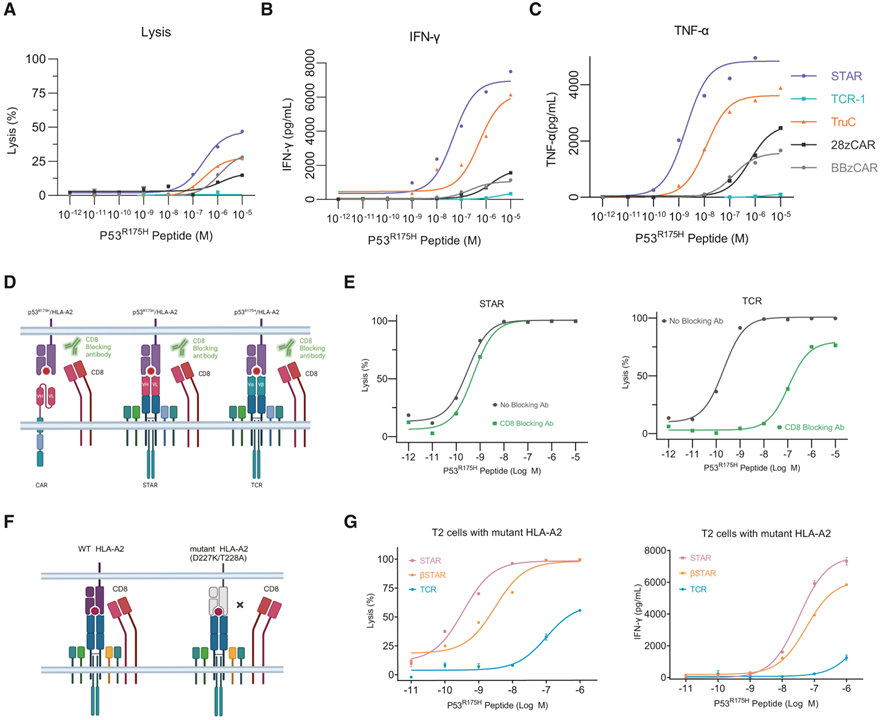
图3 CD4⁺ STAR-T和CAR–T对目的新抗原的识别不依赖CD8
进一步,研究团队通过转录组测序和染色质开放性测序(ATAC-Seq)分析了这些T细胞在抗原刺激后的转录水平以及染色质可及性变化。主成分分析(PCA)结果表明,CD8+STAR-T与TCR-T细胞表现出了较高的相似性,其中第一主成分(PC1)的基因主要与T细胞激活相关(图4 A-D)。CD4+STAR-T细胞也引起T细胞激活相关基因改变,但CD4+TCR-T细胞与未刺激T细胞相似。ATAC-Seq热图分析显示,对于CD8+T细胞(图4 E)和CD4+细胞(图4 F),STAR引起效应相关转录因子的转录调控活性增加。
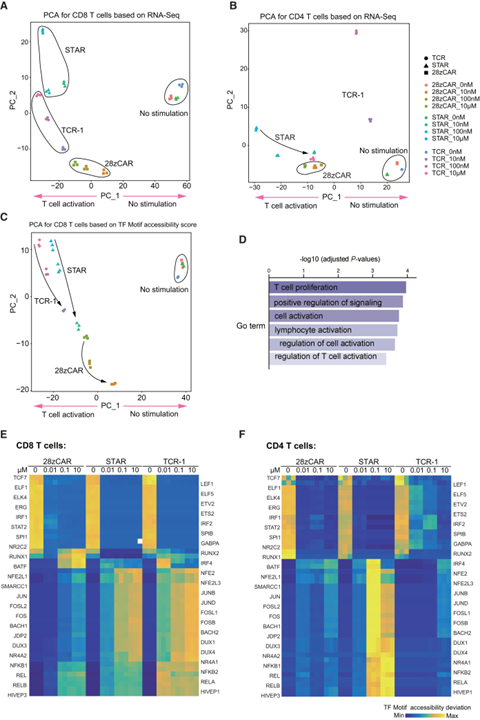
图4 CAR-T、TCR-T和STAR-T细胞的转录组学及染色质可及性分析
STAR-T对低抗原密度细胞的体外抗肿瘤作用
研究团队分别在多种呈递p53R175H新抗原的细胞上评价了STAR-T的抗肿瘤作用:1.转入HLA-A2和p53R175H全长蛋白的K-562细胞;2.天然带有p53R175H突变并转入HLA-A2的SK-BR-3细胞(图5 D F);3.天然表达两种分子的低抗原密度KLE(图5 E G)和KMS-26(图5 A-C)细胞。结果表明,STAR-T细胞对上述细胞均发挥最优的抗肿瘤效果。
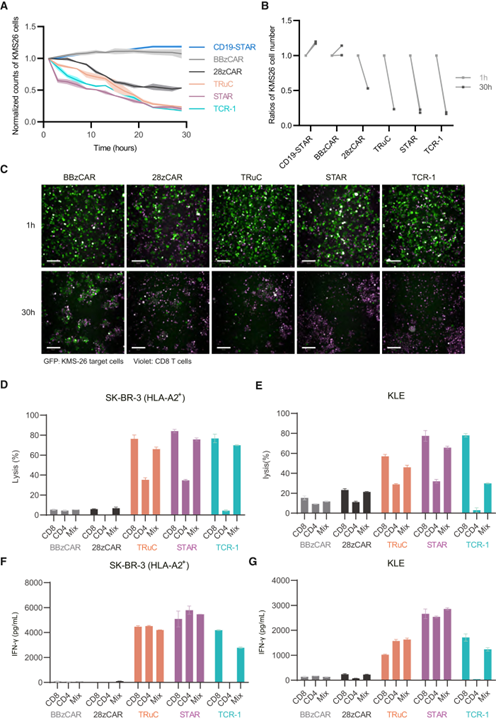
图 5 STAR-T细胞的体外抗肿瘤效果
STAR-T对低抗原密度细胞的体内抗肿瘤作用
进一步,研究团队评价了这些改造的T细胞在体内的抗肿瘤作用。结果表明,在低新抗原密度的SK-BR-3(图6 A-C)和高新抗原密度的p53R175H/HLA-A2+ K-562(图6 D-F)细胞构建的小鼠肿瘤模型中,STAR-T细胞均表现出了最好的肿瘤作用。
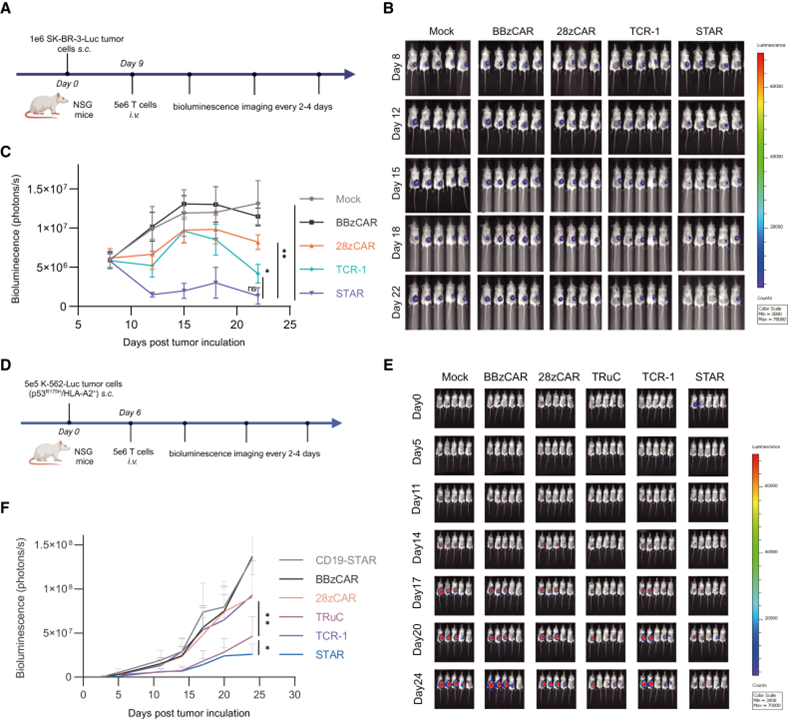
图6 STAR-T表现出对低抗原密度肿瘤良好的体内治疗效果
关注点:
1) 本研究采用的STAR策略能够靶向肿瘤细胞表面低丰度的新抗原肽段,为肿瘤的免疫治疗提供新的方案。
2) 鉴定新抗原在肿瘤细胞表面的真实呈递依赖基于质谱的方法,例如文中所用的KMS-26每细胞表面仅有1-2拷贝p53R175H新抗原,该数据便是通过质谱分析所得[2]。
3) Rapid Novor(快序生物)基于质谱和蛋白从头测序技术的Immunovor肿瘤新抗原鉴定利器,可以一网打尽来自基因组、转录组、蛋白组层面所有突变的MHC I/MHCⅡ结合肽段,用于T细胞抗肿瘤疗法的开发。
4) 本研究中利用已报道的TCRm抗体设计STAR,如果采用Rapid Novor(快序生物)的蛋白从头测序技术,可以快速对单抗或血清多抗进行测序,获得优质抗体序列用于STAR结构设计。
参考文献:
[1] Huang D, et al. TCR-mimicking STAR conveys superior sensitivity over CAR in targeting tumors with low-density neoantigens. Cell Rep. 2024 Nov 26;43(11):114949. doi: 10.1016/j.celrep.2024.114949.
[2] Hsiue EH, et al. Targeting a neoantigen derived from a common TP53 mutation. Science. 2021 Mar 5;371(6533):eabc8697. doi: 10.1126/science.abc8697.