
抗体作为一种极具潜力的生物治疗手段,正逐渐改变着多种疾病的治疗格局。抗体功能多样、半衰期长且具有模块化结构,这为治疗带来了近乎无限的可能。预计到2030年,全球单克隆抗体药物的市场将接近5000亿美元。通过合理的工程改造可以实现增强所需的免疫功能,消除不良影响。本文介绍了治疗性抗体工程改造技术发展的现状和未来。
治疗性抗体的概述
抗体根据其结构,可分为抗原结合片段(Fab)和可结晶片段(Fc)。Fab区域由基因重排和体细胞超突变产生,能精准识别并结合特定抗原;Fc区域存在多种同种型,人体内有IgG、IgM、IgA、IgD和IgE 5种(包括IgG1-4、IgA1-2亚型),该区域负责结合补体和多种Fc受体(FcR),从而引发免疫反应(图1)。通过工程改造可以获得增强或减弱这些特定Fc效应功能的单抗。治疗性抗体的研发需经历多个阶段。首先是抗体发现阶段,从众多抗体中筛选出对抗原具有特定结合能力的候选抗体;接着评估其生物学功能,并进行工程改造以优化其安全性和有效性;最后还要评估与可制造性相关的各种特性,确保抗体的可靠生产和储存。目前,获批的治疗性抗体大多属于IgG型,不过,部分基于IgE的疗法也已进入临床开发阶段。
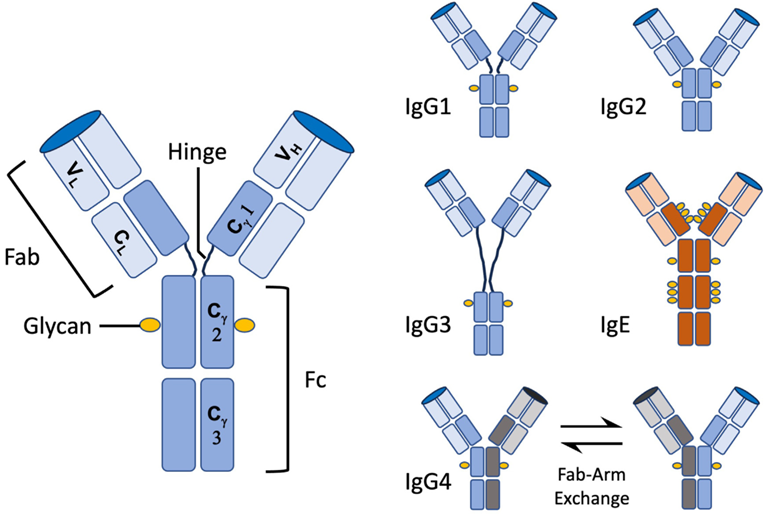
图1 抗体结构、同种型和亚型及其主要特征
抗体免疫功能的多样性
IgG抗体结合的FcR在细胞分布、糖基化以及与IgG Fc结合强度上有所差异,大致可分为FcγRI、FcγRII和FcγRIII 这3类(图2)。FcγRI、FcγRIII和FcγRIIa受体能够通过免疫受体酪氨酸激活基序(ITAM)激活细胞内的功能,而只有FcγRIIb受体通过免疫受体酪氨酸抑制基序(ITIM)传递抑制信号。FcγRI是单体IgG唯一的高亲和力受体,一定程度上是因为它与Fc聚糖的相互作用。而至于低亲和力FcγR,想要触发其信号传导,需要与多价IgG免疫复合物交联。因此在改造抗体时选择合适的IgG亚型,以及对Fc区进行改造以调节与FcR的相互作用,对实现最佳疗效而言十分必要的。
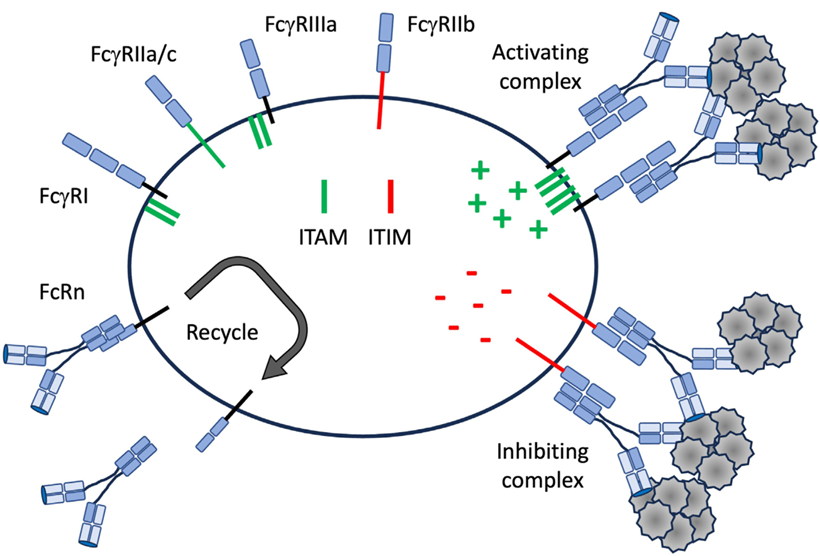
图2 FcR对效应细胞功能的调节
可变区的生成与工程改造
早期的单抗药物虽展现出了治疗潜力,然而,其作为非人源抗体,会引发严重免疫反应的风险也随之暴漏,解决该问题的一种直接有效的办法是进行人源化改造。这种方法通常将抗体轻重链互补决定区置换到人源可变结构域上,随后通过合理设计或噬菌体展示技术进行诱变,以恢复其抗原结合能力。此外,还有其他获得人源化抗体的方法,例如使用将小鼠的抗体基因座替换为人源基因座的全人源化小鼠,和多样的体外人源抗体库。为了优化抗体亲和力以及可开发性,对抗体序列的改造十分必要。通过基于多样性、相关知识或借助人工智能的方法,提高抗体的亲和力,改善稳定性、溶解性、聚集倾向、脱靶结合和化学修饰等特性;另一方面,利用抗体的模块化结构,设计出独特的价态的抗体,满足不同的应用需求。
Fc区的工程改造
在设计治疗性抗体时,首要考量的因素是不同IgG Fc亚型与受体结合特性上的天然差异。IgG1通常是含量最为丰富,且最常用于工程改造的亚型;IgG2在对抗细菌荚膜多糖抗原的免疫反应中发挥重要作用;IgG3有较大且延长的铰链区和额外的糖基化修饰,在诱导效应功能、抵御病毒和细菌感染方面尤为有效;IgG4则常在反复或长期接触抗原后产生。在治疗性抗体开发中,为避免细胞毒性,常选用IgG2或IgG4亚型,或对IgG1进行突变,使其无法与FcR或补体成分C1q结合。鉴于IgG3抗体具有强大的促炎能力,一般不考虑将其用于治疗性抗体开发。
对治疗性单抗Fc的工程改造,可影响其与FcR结合,进而从三个方面显著影响抗体疗效:增强或减弱Fc功能、延长半衰期(图3)。IgG4有一种被称为Fab臂交换的现象,即IgG4的半分子与其他IgG4分子随机交换,这种现象不利于治疗性抗体的开发。通过工程改造,例如突变S228P可以防止IgG4的Fab臂交换。除此外,对抗体糖基化的改造也是治疗药物设计中的重要因素,可以影响抗体的效应功能和稳定性。抗体Fc偶联物(如抗体偶联药物)也是研究热点。
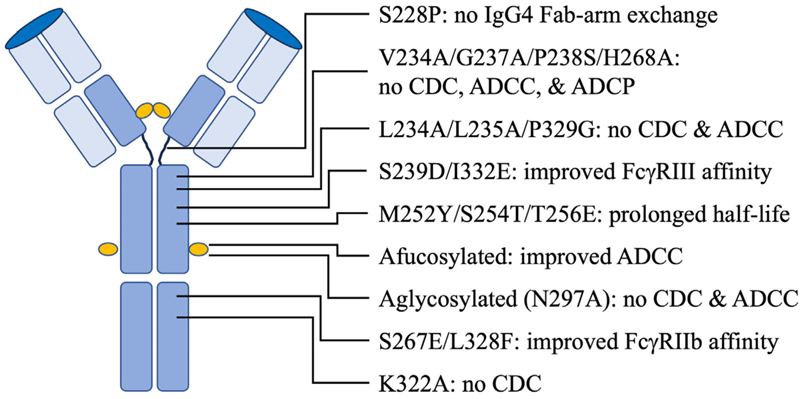
图3 Fc工程改造增强抗体的治疗效果
对抗过敏的新型抗体工程策略
至今为止,针对过敏基于抗体的治疗方法大多是非特异性的,从循环系统中大规模清除IgE。过敏领域正在研究一种现象,即源自相同B细胞库、针对同一表位的不同同种型抗体,可能会产生相互作用、调节、阻断或干扰的效应。而基于此,开发出干扰特定病理性IgE介导反应的治疗性抗体成为了新的研究方向。理论上,利用引起过敏的IgE可变区序列构建的治疗性IgG分子,经工程改造后,可具备多种理想的治疗效果(图 4):(1)改造治疗性IgG分子,使其对新生儿Fc受体(FcRn)具有更高的亲和力,从而延长血清半衰期并产生过敏原阻断效应;(2)治疗性IgG、双特异性IgG或单抗混合物与过敏原蛋白结合,阻止IgE结合,减少过敏原交联FcεRI所产生的激活信号;(3)增加抗体对FcγRIIb的亲和力,使得与过敏原结合的IgG或双特异性IgG可与FcγRIIb结合,通过过敏原特异性交联发送抑制信号;或通过引起FcεRI与FcγRIIb的共聚集来产生抑制信号,从而发挥抑制免疫细胞的效应;(4)与IgG结合的过敏原可通过FcγRIII依赖的方式被抗原呈递细胞(APCs)摄取,并呈递,进而产生或重新编程针对该过敏原的免疫耐受反应。
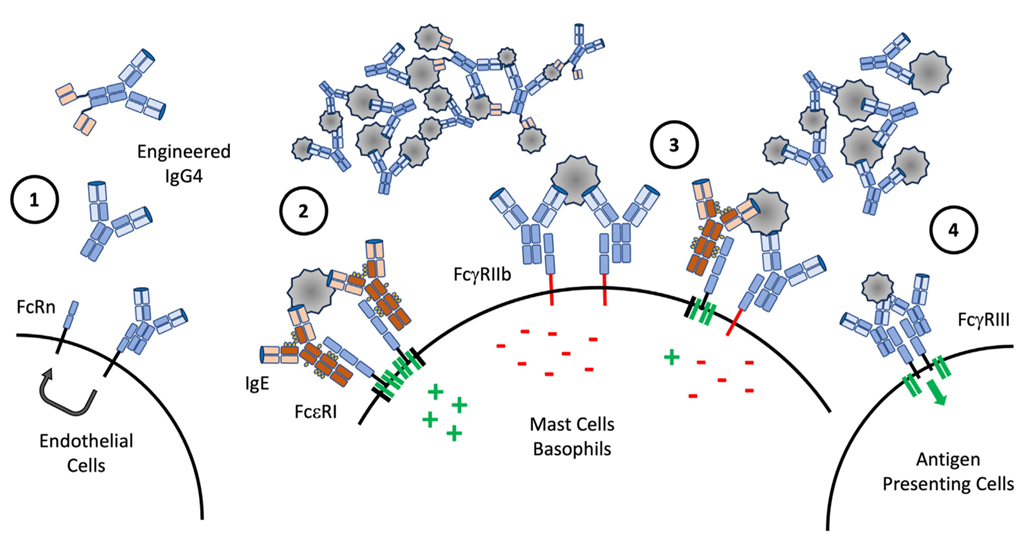
图4 理论上的过敏原阻断疗法的合理设计
此外,如今的抗体工程技术可设计出具有多种价态和特异性的抗体。由于FcεRI的交联通常是由几种IgE抗体结合在同一过敏原蛋白分子上的非重叠表位实现的。因此可以推断,多价、多特异性的IgG阻断疗法或许有助于减轻因意外接触过敏原而引发的过敏反应。未来,还能将抑制免疫细胞激活的Siglec(唾液酸结合免疫球蛋白样凝集素)配体偶联到治疗性IgG分子上,进一步下调过敏效应细胞的活性。
随着抗体工程化技术的不断发展,未来基于抗体的疗法必然会朝着更加精准、高效、多样化的方向发展。不过,目前仍面临着诸多挑战,如进一步优化抗体性能、降低免疫原性、明确某些抗体作用机制等。科研人员正不断努力,期待在这些方面取得突破,推动抗体疗法迈向新的高度。
关注点:
(1)随着对抗体研究的不断深入,治疗性抗体的作用机制、结构将越发精密,这为生物医药领域研发带来了新的机遇,也对抗体开发技术提出了更高要求。
(2)从过敏患者体内获得天然存在的过敏原特异性IgE序列,利用其可变区构建其他同种型抗体,是开发更理想的抗过敏疗法的一条可行路径,但这一设想的实现依赖于抗体发现技术的进步。
(3)Rapid Novor(快序生物)的REpAb是全球唯一基于血清多抗直接测序的抗体发现技术,可以从人和动物血清多抗蛋白中直接测得轻重链配对正确,经亲和力验证的单抗,复现原始多抗的性能,助力抗过敏等治疗性抗体的开发。
参考文献:
[1] Stone CA Jr, Spiller BW, Smith SA. Engineering therapeutic monoclonal antibodies. J Allergy Clin Immunol. 2024 Mar;153(3):539-548. doi: 10.1016/j.jaci.2023.11.018.