
摘要
作者选取25例黑色素瘤患者的肿瘤组织,用IP的方法纯化了HLA I类和HLA II类结合的多肽,检测到多达95,500个多肽。然后,将质谱数据与WES测序数据比对,筛选到11个突变肽,其中4个具有免疫原性,能刺激T细胞产生免疫反应,并在患者的肿瘤和外周血中检测到对这4个突变肽具有特异反应性的T细胞。由此得出的结论是,通过质谱法直接从原发肿瘤组织中鉴定突变新抗原是可行的,并且可以筛选到肿瘤免疫治疗密切相关的新表位。
结果
1.质谱法鉴定HLA结合的多肽
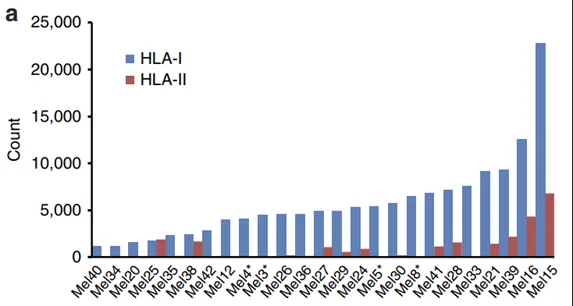
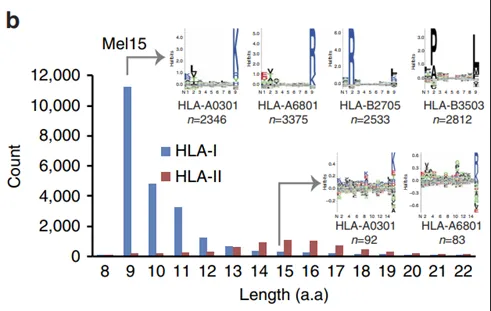
图1. HLA呈递多肽的特征
作者选取25例黑色素瘤患者的肿瘤组织纯化了HLA I类和HLA II类结合的多肽,使用先进的质谱仪对IP下来的多肽进行了LC-MS/MS测量,然后用MaxQuant进行搜库和生信分析。确定了95,662个唯一肽段序列(图1a)。在12663个蛋白中发现有78605个HLA I类肽,在2832个蛋白中发现有78605个HLA II类肽。洗脱的肽显示出特征长度分布,HLA I类肽的长度分布在9-14个氨基酸,HLA II类肽的长度分布在12-18个氨基酸(图1b)。
2.MS和WES测序联合鉴定突变肽
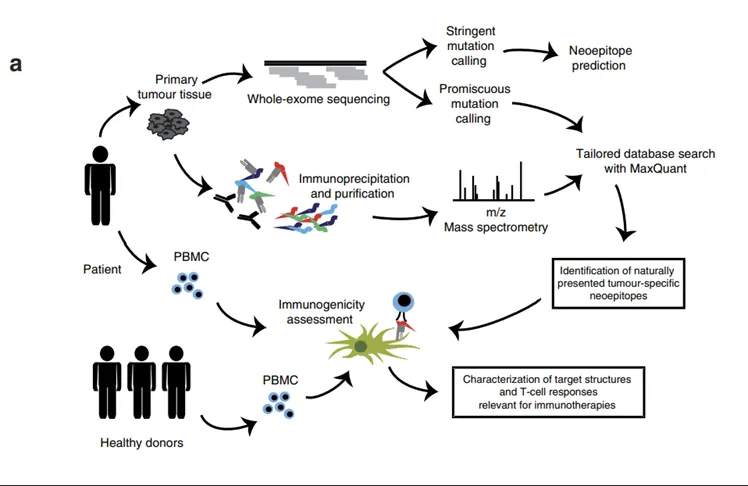
图2. 突变肽的筛选流程图
为了测试质谱的方法能否鉴定突变肽,并验证它们是否能成为新抗原(图2a),作者首先对从5例患者肿瘤中提取DNA进行了全外显子测序(WES)。然后将5名患者的MS原始数据与WES数据库进行比对,直接鉴定出11个人类原发癌症组织中的突变肽。作者合成了所有的突变肽,发现它们的MS/MS谱图和洗脱时间与内源的肽段相同。
3.检测到的磷酸化肽段
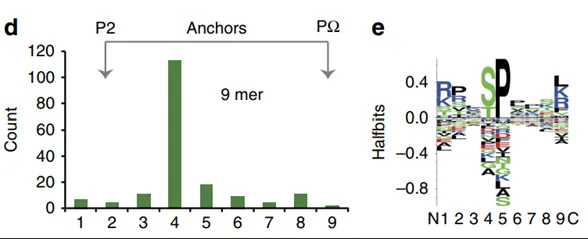
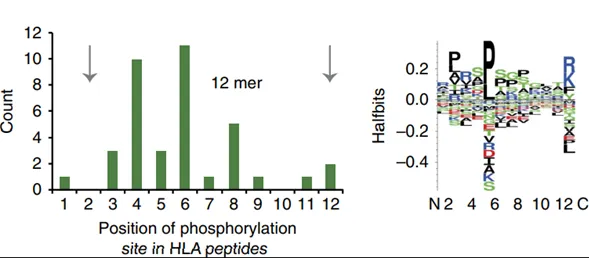
图3. 肽段磷酸化的位点
即使不用磷酸化抗体富集,作者在HLA抗体IP下来的肽段中检测到365个磷酸化肽段。经过统计后发现有78%的磷酸化发生在丝氨酸上,19%的磷酸化发生在苏氨酸上,剩下的3%在酪氨酸上。长度在9-11个氨基酸的肽段,其磷酸化修饰主要发生在第4个位点;而12个氨基酸肽段的4号和6号位的磷酸化最多 (图3d)。脯氨酸定向磷酸化也是HLA结合的磷酸化肽段的一个特征(图3e)。以上结果说明质谱法能够直接鉴定磷酸化肽段,暗示了磷酸化肽段也能成为免疫治疗的靶点。
4.突变肽的免疫原性验证
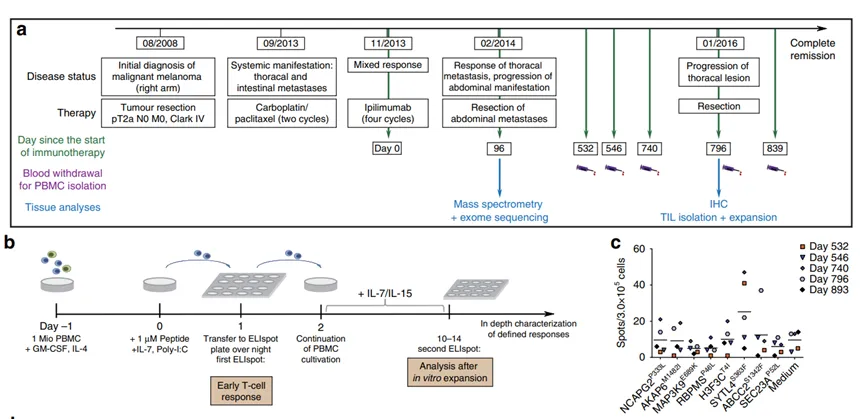
图4. T细胞对突变肽的免疫应答
为了验证质谱检测到的突变肽是否可以被患者自身T细胞识别。Mel15患者在使用Ipilimumab治疗后,经静脉穿刺取出PBMC(图4a,b)。用突变肽刺激PBMC两天后,通过ELISpot观察到明显的T细胞反应(图4c)。其中有四个突变肽能诱发T细胞反应:SYTL4S363F、NCAPG2P333L、H3F3CT4L、ABCC2S1342F。进一步研究发现,对PBMC进行长时间的刺激会导致T细胞扩增。这些T细胞对SYTL4S363F和NCAPG2P333L具有特异性,但对正常肽段没有特异性。
点评
作者首次提取出了黑色素瘤组织样本中HLA I类和II类结合的多肽,从而鉴定了近10万个天然存在于肿瘤样品中的肽段,使得质谱成为鉴定肿瘤新抗原的有力工具。即使没有进一步富集,也可以检测到含有磷酸化等翻译后修饰的肽段,表明质谱鉴定有着基因测序方法所没有的优势。通过质谱数据与WES比对后发现了11个突变肽,其中4个具有免疫原性。因此采用质谱法鉴定肿瘤新抗原是有临床应用潜力的。
关注点
采用全外显子测序(WES)和转录组测序(RNA-seq),然后通过计算机算法预测新抗原是目前常见的肿瘤新抗原鉴定方法,这种方法需要大规模的实验来验证潜在新抗原的免疫原性。而WES和MS联用可以大大缩小新抗原肽段的筛选范围,提高新抗原筛选的准确性和效率。同时,采用MS的方法还可以鉴定到基因测序无法鉴定到的翻译后修饰肽段,如上文中提到的磷酸化肽段。
参考文献:Bassani-Sternberg M , Brunlein E , Klar R ,et al.Direct identification of clinically relevant neoepitopes presented on native human melanoma tissue by mass spectrometry[J].Nature Communications, 2016, 7:13404.